Digitale zorg, e-health, Zorg op afstand, zorg-apps. Hoe je hebt ook noemt, het is geen trend meer. De categorie apps (Gezondheid) is zelfs op het moment van schrijven, Q4 2022, de op-één-na grootste app-categorie in de Google Play en Apple App Store. Tijdens de wereldwijde pandemie werd de vraag (en druk) naar zorg op afstand veel groter. Zorginstanties zijn hier massaal op ingesprongen om de druk te verlichten. Van een virtuele tandarts tot kraamzorg op afstand.
Om de kwaliteit van zulke medische hulpmiddelen te waarborgen en de risico’s te beperken is goede controle essentieel. Sinds begin 2021 heeft de Europese Unie nieuwe wetgeving ingevoerd om de kwaliteit van software te waarborgen. De regelgeving voor medische hulpmiddelen genaamd: Medical Device Regulation (MDR). Door middel van een CE-certificaat wordt deze controle Europees georganiseerd.
Dit betekend overigens niet dat alle ontwikkelde software richting de zorg moet voldoen aan MDR. Er zijn een aantal risicoklasse waar het product in kan vallen. In de laagste risicoklasse is geen MDR nodig. Hoe dit allemaal precies werkt lees je in deze blogpost…
First, things first… wat is e-health?
E-health (of eerder genoemde termen) is een verzamelnaam voor alle medische software en applicaties die (op afstand) bijdragen aan de gezondheid van mensen. Dit verhoogt niet alleen de kwaliteit van de zorg, het kan ook helpen om de gezondheidszorg betaalbaar te houden.
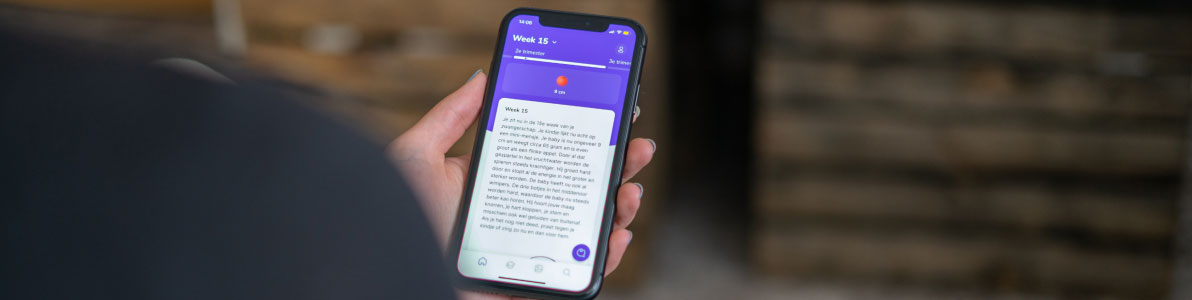
Een goed voorbeeld van e-health is BabyManager. De digitale kraamzorg in de vorm van een native iOS en Android app. Toekomstige en kersverse ouders krijgen door middel van educatieve video’s, cursussen en week-op-week informatie alle kennis die ze nodig hebben tijdens en na de zwangerschap. Hebben ze alsnog een brandende vraag? Via chat of videobellen staan er 24/7 kraamzorg professionals voor hun klaar. Toegang tot deze app wordt dan ook vergoed door alle zorgverzekeraars in Nederland. Omdat deze applicatie in de lage risicoklasse valt is er ook geen certificering nodig.
Medical Device Regulation (MDR)
Deze nieuwe wetgeving is in het leven geroepen ervoor te zorgen dat alle medische hulpmiddelen niet alleen veilig zijn, maar ook de juiste data laten zien, veilig omgaan met persoonsgegevens en er duidelijk is hoe ze gebruikt moeten worden.
Wat is de CE-certificering?
Je kan onderscheid maken tussen de CE-markering en de CE-certificering. De CE-markering zie je op veel producten terug, deze wordt zelf door de fabrikant op het product geplaatst.
“Met CE-markering verklaart de fabrikant dat zijn producten zijn getoetst aan alle toepasselijke EU-wetgevingen die CE-markering vereisen en overeenstemmen met de gezondheids-, veiligheids-, prestatie- en milieu-eisen die relevant zijn voor die producten.” – Rijksoverheid https://www.rvo.nl/onderwerpen/eu-wetgeving/ce-markering
De CE-certificering op medische hulpmiddelen wordt uitgegeven door een onafhankelijke partij die het product toetst op alle EU-wetgeving met de gezondheids-, veiligheids, prestatie- en milieu-eisen die relevant zijn. Deze certificering/markering geldt dus ook voor medische hulpmiddelen, zoals een mobiele applicatie en/of web-app die voldoet aan de MDR. Dit zorgt er niet alleen voor dat de kwaliteit en veiligheid omhoog gaat. Ook zorgt dit voor de nodige transparantie in de markt van digitale zorg / e-health.
Hoe krijg ik de CE-markering voor mijn software? (4 stappen)
De rijksoverheid beschouwd e-health software ook gewoon als product. Daarvoor moet er eerste gekeken wordt in elke risicoklasse de software valt: klasse I (laag risico), klasse IIa en IIb (middelhoog risico) en klasse III (hoog risico). Om het helemaal complex te maken wordt er ook nog onderscheid gemaakt tussen MDR of In Vitro Diagnostic Regulation (IVDR). Het laatste betreft alleen software dat onderzoek doet naar micro-organismen, cellen en bio-moleculen.
Stap 1: Vaststellen in welke risicoklasse voor jouw hulpmiddel van toepassing is.
De eerste stap is het analyseren van jouw product. Het kan namelijk zo zijn dat het er voor jouw ontwikkeling helemaal geen CE-certificering nodig is. De Rijksoverheids schrijft hier genoeg over. Ook heeft het een uitgebreid document opgesteld waarin de risicoklassen toegelicht staan. Let op: dit is wel een juridisch document van meer dan 175 pagina’s
https://eur-lex.europa.eu/legal-content/NL/TXT/PDF/?uri=CELEX%3A32017R0745&from=EN
Stap 2: Vervolg kiezen
Op basis van de eerste stap zijn er een aantal opties mogelijk:
1. Het hulpmiddel (de software) valt buiten de risicoklasse
Jouw hulpmiddel is geen medisch hulpmiddel. Er is dus geen CE-certificering nodig.
2. Het hulpmiddel valt onder lage risicoklasse
Jouw hulpmiddel wordt beschouwd als een medisch hulpmiddel. Een CE-markering is voldoende.
3. Het hulpmiddel valt in de midden of hoge risicoklasse
Jouw hulpmiddel wordt beschouwd als een medisch hulpmiddel met middel/hoge risico’s. Het hulpmiddel dient gecertificeerd te worden door een aangemelde instantie.
Stap 3: Technisch rapport
De volgende stappen zijn alleen relevant indien het een medische hulpmiddel betreft met een lage, middel of hoge risicoklasse. Ongeacht de risicoklasse van een product, moet iedere fabrikant voldoen aan de essentiële veiligheids- en prestatie eisen en moet er technische documentatie worden opgesteld. In dit document (QMS 13485) staat alles beschreven over ontwikkeling, implementatie en risicomanagement van de applicatie.
Stap 4: Hulpmiddel aanmelden bij European Databank on Medical Devices (EUDAMED)
Inclusief de technisch documentatie kan de aanvraag voor de certificering of markering ingediend worden bij de EUDAMED voor de EU-conformiteitsverklaring. Als alles is goedgekeurd ontvang je de CE-markering (lage risico) of als je het proces doorloopt via een aangemelde instantie, ontvang je de CE-certificering.
CE-Certificering is een doorlopend proces
Ook na het ontvangst van een markering of certificering dient de technische documentatie ten alle tijden up-to-date te zijn door middel van een Quality Management System. Eventuele veranderingen in de software en incidenten dienen hier in opgenomen te zijn. Veranderd de focus (belangrijkste functionaliteiten) van de applicatie volledig? Dan is nieuwe certificering noodzakelijk.
Technisch partner voor Medische software en zorg-apps
Wij vertalen het liefst complexe problemen naar intuïtieve oplossingen die impact maken. Digitale zorg is hier een perfect voorbeeld van. Wij hebben in de afgelopen 8 jaar al meerdere zorg apps ontwikkeld voor onder andere Kraamzorg De Waarden, RadboudUMC en UMCG. Daarnaast beschikken wij als software ontwikkelaar NEN-7510 (Informatiebeveiliging voor de zorgsector in Nederland).
Heb jij het idee om de zorg (op afstand) te verbeteren? Neem dan contact met ons op. App ontwikkelaars met een missie. Let’s make impact!

Neem contact op
Wil jij een app laten maken of graag meer weten? Neem vrijblijvend contact op en ik help je graag verder.
CONTACT
Heb je een vraag? Neem vrijblijvend contact op en ik help je graag verder.